Giriş:
Selam sevgili 8. sınıf öğrencileri! Fen bilgisi dersinin heyecan verici bir ünitesine, “Madde ve Endüstri“ye hoş geldiniz! Bu ünitenin ilk ve en temel konusu olan “Periyodik Sistem”i keşfetmeye hazır mısınız? Periyodik sistem, etrafımızdaki tüm maddelerin yapı taşları olan elementleri düzenli bir şekilde gösteren bir tablodur. İlk bakışta karmaşık gibi görünse de, aslında çok mantıklı ve düzenli bir yapısı var. Ayrıca bu yazımızda, periyodik sistemi tüm detaylarıyla, tarihçesiyle, amacı ve elementlerin özellikleriyle birlikte inceleyeceğiz. Sonuç olarak, LGS yolculuğunuzda size rehberlik edecek bu eksiksiz rehberi kaçırmayın! Konuya ilişkin daha detaylı bilgilere YouTube kanalım üzerinden ulaşabilirsiniz.
Periyodik Sistem Nedir? Ne İşe Yarar?
Periyodik sistem (veya periyodik cetvel, periyodik tablo), elementleri belirli özelliklerine göre sınıflandıran ve düzenli bir şekilde gösteren tablodur. Bu sistem, bilim insanlarına elementlerin özelliklerini tahmin etme, aralarındaki ilişkileri anlama ve yeni elementler keşfetme konusunda yardımcı olur. Örneğin, bir kütüphanede kitapların düzenli bir şekilde sınıflandırılması gibi, periyodik sistem de elementlerin düzenli bir şekilde sınıflandırılmasıdır.

Periyodik Sistemin Tarihçesi: Bilimin Uzun Yolculuğu
Periyodik sistemin bugünkü haline gelmesi, uzun ve meşakkatli bir sürecin ürünüdür. Bununla birlikte, Antik Yunan’dan günümüze kadar birçok bilim insanı bu konuda çalışmalar yapmıştır.
- Aristoteles: İlk fikirleri ortaya atanlardan biri olan Aristoteles, doğadaki her maddenin dört ana unsurdan (ateş, su, toprak ve hava) oluştuğunu ileri sürmüştür. Ancak bu fikir, günümüzdeki bilimsel anlayıştan oldukça farklıdır.
- Democritus: Maddelerin atomlardan oluştuğu fikrini ilk ortaya atanlardandır.
- Atom Modelleri: John Dalton, J.J. Thomson, Rutherford gibi bilim insanları, atom modellerini geliştirerek maddenin yapısını anlamamıza yardımcı oldular.
- Elementlerin Keşfi: Zamanla birçok element keşfedildi. Bilim insanları, bu elementleri sınıflandırma ihtiyacı duydular.
Periyodik Sistem İçin İlk Adımlar:
- Johann Döbereiner (Alman): Elementleri benzer özelliklerine göre üçerli gruplandırmıştır (Triadlar Yasası). Soyadındaki üç nokta, üçerli gruplandırmayı hatırlamanıza yardımcı olabilir.
- Alexandre-Émile Béguyer de Chancourtois (Fransız): Elementleri silindirik bir şekilde sıralamış ve benzer özellik gösteren elementlerin dikey sıralarda bulunduğunu fark etmiştir.
- John Newlands (İngiliz): Elementleri atom ağırlıklarına göre sıralamış ve her 8 elementte bir benzer özelliklerin tekrar ettiğini görmüştür (Oktavlar Yasası). Bu benzerliği müzik notalarına benzetmiştir.
Periyodik Sistemin Mimarları:

- Dimitri Mendeleev (Rus) ve Lothar Meyer (Alman): Birbirlerinden bağımsız olarak benzer periyodik tablolar oluşturmuşlardır. Mendeleev, elementleri atom ağırlıklarına göre sıralarken, Meyer benzer fiziksel özelliklere göre sıralamıştır. Mendeleev’in tablosu, günümüzdeki periyodik sisteme daha yakın olduğu için daha çok tanınmaktadır.
- Henry Moseley (İngiliz): Periyodik sistemi atom numaralarına (proton sayılarına) göre sıralamıştır. Bu sıralama, günümüzdeki periyodik sistemin temelini oluşturur. Moseley, 1915 yılında Çanakkale Savaşı sırasında hayatını kaybetmiştir.
- Glenn Seaborg (Amerikalı): Periyodik tablonun altına lantanit ve aktinit serilerini ekleyerek tabloya son şeklini vermiştir.
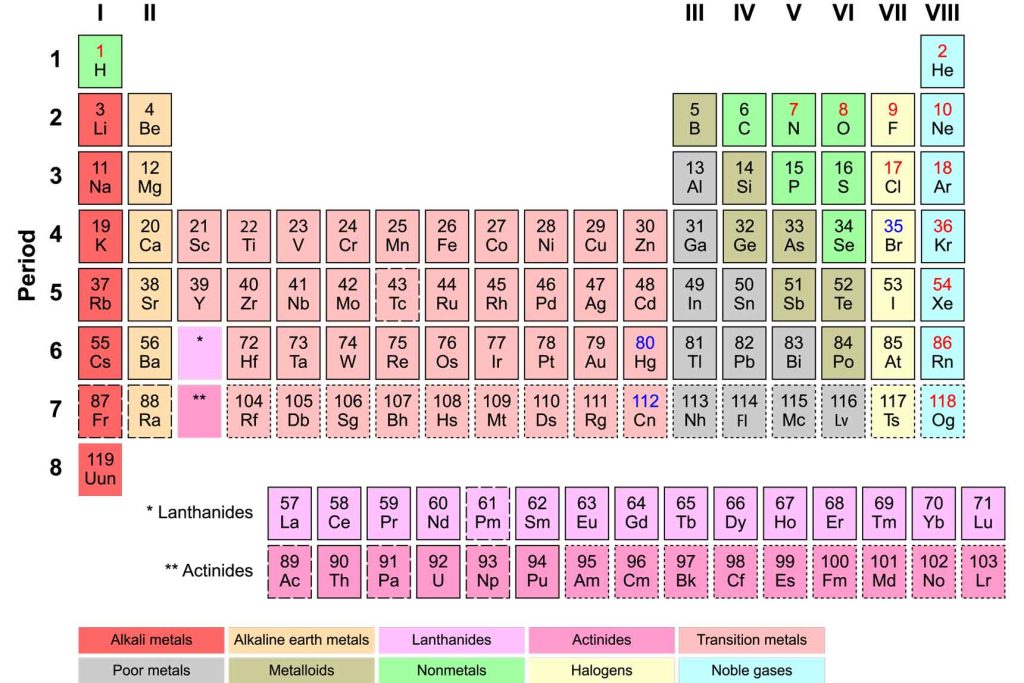
Periyodik Tablo Nasıl Bir Şeye Benziyor?
Şimdi de periyodik tablonun yapısını inceleyelim:
- Grup: Dikey sütunlara “grup” adı verilir. Periyodik tabloda toplam 18 grup bulunur. Aynı grupta bulunan elementler genellikle benzer kimyasal özellikler gösterirler.
- Periyot: Yatay sıralara “periyot” adı verilir. Periyodik tabloda toplam 7 periyot bulunur.
- A Grupları: 1A, 2A, 3A, 4A, 5A, 6A, 7A ve 8A gruplarıdır. Bu gruplardaki elementler, temel kimyasal özelliklere sahiptir.
- B Grupları (Geçiş Metalleri): A gruplarının arasında yer alan 10 tane gruptan oluşur. Bu gruplardaki elementler, genellikle değişken değerlik alırlar.
- Elementlerin Sembolleri: Elementler, periyodik tabloda sembollerle gösterilirler. Semboller genellikle elementin Latince adının kısaltmasıdır.
Elementlerin Elektron Dizilimi ve Periyodik Tablodaki Yeri:
Elementlerin periyodik tablodaki yerini belirlemek için elektron dizilimlerini kullanırız.
- Atom Numarası: Bir elementin atom numarası, çekirdeğindeki proton sayısına eşittir. Nötr bir atomda, proton sayısı elektron sayısına eşittir.
- Elektron Dizilimi: Elektronlar, atom çekirdeği etrafında belirli enerji seviyelerinde (yörüngelerde) bulunurlar. İlk yörüngeye en fazla 2 elektron (dublet kuralı), ikinci ve üçüncü yörüngelere en fazla 8 elektron (oktet kuralı) yerleşebilir.
- Grup Numarası: Son yörüngedeki elektron sayısı (değerlik elektron sayısı), elementin hangi grupta bulunduğunu gösterir.
- Periyot Numarası: Elementin kaç tane enerji seviyesi (yörüngesi) varsa, o element o periyotta bulunur.
Örnek:
Lityum (Li): Atom numarası 3. Elektron dizilimi: 2, 1. Son yörüngesinde 1 elektron olduğu için 1A grubunda, 2 tane yörüngesi olduğu için 2. periyotta bulunur.
Periyodik Tablodaki Element Sınıfları:
Elementler, genel özelliklerine göre üç ana sınıfa ayrılır:
- Metaller: 1A, 2A ve 3A gruplarında bulunurlar (hidrojen hariç). Isıyı ve elektriği iyi iletirler, parlak görünümlüdürler, tel ve levha haline getirilebilirler (işlenebilirler). Elektron verme eğilimindedirler ve katyon (artı yüklü iyon) oluştururlar. Alkali metaller (1A), toprak alkali metaller (2A) ve toprak metalleri (3A) gibi özel isimleri vardır.
- Ametaller: 5A, 6A ve 7A gruplarında bulunurlar. Isıyı ve elektriği iyi iletmezler, mat görünümlüdürler, kırılgan yapıdadırlar. Elektron alma eğilimindedirler ve anyon (eksi yüklü iyon) oluştururlar. Halojenler (7A) gibi özel isimleri vardır.
- Yarı Metaller (Metalloidler): Metal ve ametaller arasında, merdiven şeklinde bulunurlar. Bazı özellikleri metallere, bazı özellikleri ametallere benzer. Isıyı ve elektriği metallerden kötü, ametallerden iyi iletirler. Bor (B), silisyum (Si) ve germanyum (Ge) en bilinen yarı metallerdir.
- Soygazlar (Asal Gazlar): 8A grubunda bulunurlar. Kararlı yapıdadırlar (son yörüngeleri dolu olduğu için). Bileşik oluşturma eğiliminde değillerdir. Neon (Ne), argon (Ar) gibi elementlerdir.
Metaller ve Ametallerin Özellikleri Karşılaştırması:
| Özellik | Metaller | Ametaller |
| İletkenlik | İyi iletirler | Kötü iletirler |
| Görünüm | Parlak | Mat |
| İşlenebilirlik | Tel ve levha haline gelirler | Kırılgandırlar |
| Elektron Eğilimi | Elektron verme eğiliminde | Elektron alma eğiliminde |
| İyon Oluşturma | Katyon oluştururlar | Anyon oluştururlar |
Metal ve Ametal Bileşikleri:
- Metaller kendi aralarında bileşik oluşturmazlar.
- Ametaller kendi aralarında bileşik oluşturabilirler.
- Soygazlar kararlı oldukları için bileşik oluşturmazlar.
Sonuç:
Sevgili 8. sınıf öğrencileri, bu yazımızda periyodik sistemin ne olduğunu, tarihçesini, yapısını, elementlerin sınıflandırılmasını ve özelliklerini detaylı bir şekilde inceledik. Periyodik sistemi anlamak, kimyayı anlamanın temelidir. Umarım bu bilgiler, LGS sınavına hazırlanırken size yardımcı olur. Bol bol tekrar yapmayı ve soru çözmeyi unutmayın! Sıradaki üniteyi çalışmayı da unutmayın. Bir sonraki yazımızda görüşmek üzere!
