Asitler ve bazlar, 8. sınıf fen bilimleri müfredatının önemli konularındandır. Günlük yaşamda yiyeceklerden temizlik malzemelerine kadar pek çok asit ve baz ile karşılaşırız. Örneğin, limon suyu gibi besinler asidik özellik gösterirken sabun gibi maddeler bazik özellik gösterir. Peki, asitler ve bazlar nedir, özellikleri nelerdir ve nasıl ayırt edilirler? Bu yazıda asitlerin ve bazların temel özelliklerini, günlük yaşamdan örneklerini, aralarındaki önemli tepkimeleri (örn. nötrleşme) ve asit-baz ayrımı yöntemlerini ele alacağız. Konuya ilişkin daha detaylı bilgilere Youtube kanalımdan ulaşabilirsiniz.
Daha fazla ders içeriği için blog sayfamızı ziyaret edebilirsiniz
Asit Nedir?
Asitler, suda çözündüklerinde ortamda hidrojen iyonu (H⁺) oluşturan maddelerdir. Bu nedenle asit çözeltilerinde H⁺ iyonu fazladır. Asitlerin tatları genellikle ekşidir (örneğin limonun ekşiliği sitrik asitten gelir). Turnusol kağıdı gibi indikatörlerde, asitler mavi turnusolü kırmızıya çevirir. Ayrıca asit çözeltileri elektrik akımını iletir ve metallere temas ettiğinde tepkimeye girip hidrojen gazı açığa çıkarabilir; bu yüzden asitler metaller üzerinde aşındırıcı etkiye sahiptir.
Kimyasal açıdan güçlü ve zayıf asitler vardır. Kuvvetli asitler suda hemen hemen tamamen iyonlarına ayrışır. Örneğin hidroklorik asit (HCl), nitrik asit (HNO₃) ve sülfürik asit (H₂SO₄) yaygın kuvvetli asitlerdir. Zayıf asitler ise suda kısmen iyonlaşır; meyvelerdeki sitrik asit (limon asidi) veya asetik asit (sirke asidi) gibi asitler bu gruptadır. Asitlerin bazı kullanım alanları: Tuz ruhu adıyla bilinen hidroklorik asit evlerde temizlik amacıyla kullanılır, akü sıvılarında sülfürik asit bulunur, gübre ve patlayıcı yapımında nitrik asit (kezzap) kullanılır. Mide asidi olarak bilinen hidroklorik asit ise sindirimde görev alır. Yiyecek ve içeceklerde bulunan asitler (örneğin gazlı içeceklerdeki karbonik asit veya koladaki fosforik asit) genellikle zayıf asit olmalarına rağmen fazla alındığında diş minesine ve mideye zarar verebilir.

Baz Nedir?
Bazlar ise suda çözündüklerinde ortamda hidroksit iyonu (OH⁻) oluşturan maddelerdir. Bir başka deyişle, bazik çözeltilerde OH⁻ iyonu fazladır. Bazların tatları genellikle acıdır (örneğin sabunun acımsı tadı) ve el ile dokunulduğunda kayganlık hissi verir (sabunlu suyun kayganlığı bu özelliktendir). Bazlar kırmızı turnusol kağıdını maviye çevirir, yani asitlerin tersine indikatörlerde farklı renk verirler. Bazik çözeltiler de elektrik akımını iletir ve güçlü bazlar da aşındırıcı olabilir; örneğin kuvvetli bir baz olan sodyum hidroksit cilde temas ederse kaygan ama yakıcı bir his oluşturur.

Bazlar da güçlü ve zayıf olarak sınıflandırılabilir. Kuvvetli bazlar (örneğin sodyum hidroksit – NaOH ve potasyum hidroksit – KOH) suda tamamen iyonlaşır ve çok kaygan/yakıcı özelliktedir. Zayıf bazlar ise kısmen iyonlaşır; örneğin evlerde temizlikte kullandığımız amonyak çözeltisi (NH₃) keskin kokulu zayıf bir bazdır. Günlük yaşamda bazların en bilinen örneklerinden biri sabundur – sabun yapımında NaOH gibi kuvvetli bazlar kullanılır. Çamaşır suyu gibi birçok temizlik malzemesi bazik özellik gösterir. Diş macunu da genellikle hafif baziktir; ağızdaki asitleri nötralize ederek diş çürümesini önlemeye yardımcı olur.
Günlük Yaşamda Asitler ve Bazlar (Örnekler)
Günlük hayatımızda çeşitli asit ve baz içeren maddelerle karşılaşırız. Aşağıdaki tabloda bazı yaygın örnekler ve özellikleri listelenmiştir:
| Madde | Türü | İçerdiği Madde / Özellik |
|---|---|---|
| Limon suyu | Asit | Sitrik asit içerir (pH ≈ 2-3, oldukça asidik) |
| Sirke | Asit | Asetik asit içerir (pH ≈ 2-3, asidik) |
| Gazlı içecek (Kola) | Asit | Karbonik asit ve fosforik asit içerir (asitli içecek) |
| Yoğurt | Asit | Laktik asit içerir (fermentasyon ürünü, ekşi tad verir) |
| Mide özsuyu | Asit | Hidroklorik asit içerir (sindirim sıvısı, pH ≈ 1-2) |
| Sabun | Baz | Üretiminde sodyum hidroksit (NaOH) kullanılır, bazik özelliktedir |
| Çamaşır suyu | Baz | Sodyum hipoklorit içeren bazik bir çözelti (kuvvetli dezenfektan) |
| Amonyak (temizlik maddesi) | Baz | Amonyak çözeltisi içerir (keskin kokulu, bazik) |
| Kabartma tozu (Karbonat) | Baz | Sodyum bikarbonat içerir (zayıf baz, hamur kabartmada ve mide asidini nötrleştirmede kullanılır) |
Bu örneklerden de görüleceği gibi, asitler ve bazlar mutfaktan banyoya birçok yerde karşımıza çıkar. Limon ve sirke gibi asitler yiyeceklere tat vermenin yanı sıra mikrop öldürücü özelliğe de sahip olabilir. Sabun, deterjan, çamaşır suyu gibi bazlar ise temizlikte vazgeçilmezdir. Örneğin, midemiz çok asitliyken karbonatlı su içmek asitliği azaltarak rahatlama sağlar – bu bir nötralleşme örneğidir (baz olan karbonat, mide asidini kısmen nötralize eder). Ancak asit ve baz içeren maddeleri kullanırken dikkatli olunmalıdır; güçlü asit ve bazlar cilde ve gözlere zarar verebilir, bu yüzden koruyucu eldiven/gözlük kullanmak ve maddeleri karıştırmamak önemlidir.

Asit-Baz Tepkimeleri (Nötrleşme)
Asitler ve bazlar birbirleriyle tepki verdiklerinde nötrleşme tepkimesi gerçekleşir. Nötrleşme, bir asit + baz karışımından tuz ve su oluşması olayıdır. Bu tepkime sonucunda asidin asidik, bazın bazik özelliği birbirini götürür ve ortaya çıkan çözeltinin pH değeri 7’ye, yani nötr hale yaklaşır. Tam dengeli bir nötrleşme tepkimesinde çözelti nötr (pH 7) olur. Örneğin, hidroklorik asit (HCl) ile sodyum hidroksit (NaOH) tepkimeye girdiğinde sodyum klorür (NaCl, sofra tuzu) ve su oluşur:
HCl + NaOH → NaCl + H₂O

Yukarıdaki denkleme göre asitten gelen H⁺ ile bazdan gelen OH⁻ birleşerek H₂O (su) oluşturur; geriye kalan iyonlar tuzu meydana getirir. Günlük hayattan bir örnek verirsek, mide asidinin fazla olduğu durumlarda alınan antiasit tabletler veya karbonatlı su, midede nötrleşme tepkimesi oluşturarak fazla asidi giderir. Benzer şekilde arı sokması (asit etkisi) durumunda üzerine sürülen sabunlu su veya amonyaklı solüsyon baz içerdiği için acıyı alır; tersine bazik bir böcek sokmasında (ör. arı sokması genelde asidiktir, ancak bazı böcek zehirleri baziktir) sirke sürmek asidik olduğundan nötrleştirir.
Asitlerin bir diğer önemli tepkimesi de aktif metallerle reaksiyonlarıdır. Asitler, bazı metallerle tepkimeye girdiklerinde hidrojen gazı açığa çıkarırlar.
Örneğin, çinko metali + hidroklorik asit → çinko klorür + hidrojen gazı şeklinde bir tepkime gerçekleşir. Bu yüzden güçlü asitler metal kaplarda saklanmaz; hidrojen gazı basınç oluşturup tehlikeli olabilir ve metal kap zamanla delinip aşınır. Bazlar ise yağları sabunlaştırma (saponifikasyon) tepkimeleri ile bilinir; örneğin yemeklik yağ + NaOH → sabun + gliserol şeklinde bir reaksiyon, endüstride sabun üretiminde kullanılır.
Asitleri ve Bazlar Ayırt Etme Yöntemleri
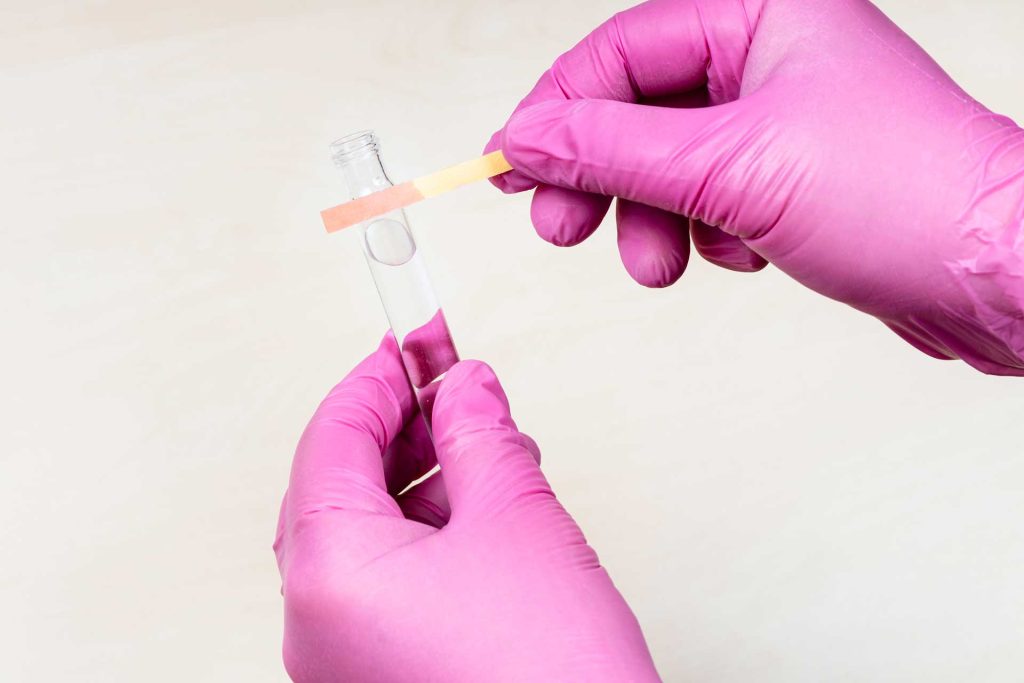
Asit mi baz mı? Bir çözeltinin asidik mi bazik mi olduğunu anlamak için belirteç (indikatör) adı verilen özel maddeler kullanılır. İndikatörler, çözeltinin pH değerine göre farklı renk alarak bize ortamın asitlik/bazlık durumunu gösterir. En yaygın kullanılan indikatörlerden bazıları turnusol kağıdı, fenolftalein ve metil oranjdır. Örneğin, turnusol kağıdı, asidik ortamda kırmızı renge dönerken bazik ortamda mavi renk alır. Aşağıdaki tabloda bazı yaygın pH indikatörleri ve renk değişimleri özetlenmiştir
| İndikatör | Asidik Çözeltide | Bazik Çözeltide |
|---|---|---|
| Turnusol Kağıdı | Kırmızı renk | Mavi renk |
| Fenolftalein | Renksiz (şeffaf) | Pembe (fuşya) |
| Metil Oranj | Kırmızı | Sarı |
| Mor Lahana Suyu | Kırmızı | Yeşil / Mavi |
Yukarıdaki indikatörler sayesinde laboratuvarda ya da evde basitçe bir maddenin asit mi baz mı olduğunu test edebiliriz. Örneğin, sirke içine birkaç damla fenolftalein damlatırsak çözeltide hiçbir renk değişimi olmaz (çünkü sirke asidiktir, fenolftalein asitte renksiz kalır). Aynı indikatörü sabunlu suya damlatırsak çözeltinin pembe olduğunu görürüz (bazik ortamda fenolftalein pembe renk alır). Turnusol kağıdı kullanılırsa, mavi turnusol asidik çözeltiye batırıldığında kırmızıya döner; kırmızı turnusol bazik çözeltiye batırıldığında maviye döner.Ayrıca, doğal bir indikatör örneği olarak mor lahana suyu da benzer şekilde asitte kırmızı, bazda yeşilimsi mavi renk verir.

Yaygın maddelerin pH değeri aralığını gösteren pH ölçeği. 0-7 arası asidik, 7 nötr, 7-14 arası bazik ortamdır. Günlük hayattan limon, sirke gibi maddeler ölçeğin asidik (kırmızı) tarafında, sabun, çamaşır suyu gibi maddeler bazik (mavi) tarafında yer alır.
pH Ölçeği
Yukarıdaki pH ölçeği görselinde, farklı maddelerin pH değerleri üzerinde nerede yer aldığı gösterilmektedir. pH değeri bir çözeltinin asitlik veya bazlık seviyesini 0’dan 14’e kadar bir skalada ifade eder. pH 7 nötrdür. (ne asit ne baz, örneğin saf su), pH < 7 asidik, pH > 7 bazik özelliktedir. Kuvvetli asitlerin pH değerleri 0-1 gibi çok düşük, kuvvetli bazların pH değerleri ise 13-14 gibi yüksektir. Örneğin mide asidi ~1-2 pH ile oldukça güçlü bir asittir, limon suyu ~2-3 pH, kahve ~5 pH ile hafif asidiktir. Sabunlu su ~9-10 pH değerinde bazik, çamaşır suyu ise ~12-13 pH ile oldukça kuvvetli baziktir. Evrende var olan suların pH değeri 7 ise nötr kabul edilirken, asit yağmurlarının pH’ı 5-6 civarına düştüğü için asidik kabul edilir (bu da havadaki kirlilikten kaynaklanır).
Asit ve Bazların Ayrımı
Bu ayrımı, pH metre veya pH kağıdı da kullanılır. pH kağıdı, içine batırıldığı çözeltinin pH değerine göre çeşitli renk alır ve yanında verilen renk skalası ile karşılaştırılarak yaklaşık pH değeri okunur. Dahası, bu yöntem ile bir maddenin kuvvetli asit mi zayıf asit mi olduğunu ya da nötr olup olmadığını yaklaşık olarak belirlemeye yardımcı olur.
Sonuç
Özetlemek gerekirse, asitler ve bazlar hayatımızın her alanında karşımıza çıkan, kimyanın temel iki madde grubudur. Asitler ekşi tatları ve aşındırıcı özellikleriyle, bazlar acı tat ve kayganlık hissiyle ayırt edilir. Birbirleriyle tepkimeye girdiklerinde nötrleşerek tuz ve su oluştururlar. Gerek laboratuvarda gerek evde, indikatörler ve pH ölçeği yardımıyla bir maddenin asit mi baz mı olduğunu anlayabiliriz. Bu temel bilgiler, fen bilimleri dersinde öğrendiğimiz kimyasal kavramların günlük yaşamdaki karşılıklarını anlamamıza yardımcı olur. Unutmayalım, asit ve bazlarla çalışırken güvenlik kurallarına uymak (örneğin gözlük, eldiven kullanmak ve güçlü kimyasalları karıştırmamak) son derece önemlidir. Bilinçli kullanıldığında ise asitler ve bazlar, hem evde hem endüstride bizlere fayda sağlayan vazgeçilmez kimyasal araçlardır.
